Hasta el 22 de febrero de 2022, el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) ha infectado a más de 427 millones de personas y causado más de 5,7 millones de muertes. A pesar de la alta cobertura de vacunación, las variantes de deriva antigénica son una preocupación inevitable y, por lo tanto, representan amenazas importantes para la salud mundial.
En un estudio reciente publicado en bioRxiv * Servidor de preimpresión, los investigadores exploran el potencial de las nanopartículas de dominio de unión al receptor de mosaico en la inmunidad protectora contra el SARS-CoV-2. Con este fin, los investigadores adoptaron la teoría de que un antígeno nuclear de células proliferantes (PCNA) autoensamblado único, una proteína en forma de anillo, podría generar partículas de nanomosaico distribuidas uniformemente compuestas de antígenos heterogéneos.
estancia: Las nanopartículas asociadas al receptor de mosaico inducen inmunidad protectora contra los desafíos del SARS-CoV-2. Haber de imagen: Yeti punteado/Shutterstock.com
Construcción de partículas de nano-mosaico
Como andamio, el PCNA heterocíclico se produce a partir de S. solfataricus Con tres subunidades PCNA diferentes 1, 2 y 3 utilizadas para el estudio actual. A pesar de su modesta similitud de secuencia que era del orden del 8-22%, estas subunidades de 250 aminoácidos tienen estructuras similares y están agrupadas secuencialmente. Con este fin, PCNA1 y PCNA2 forman un dímero estable, que utiliza PCNA3 para formar un trímero heterodímero con constantes de disociación dentro del rango micromolar (µM) a milimolar (mM).
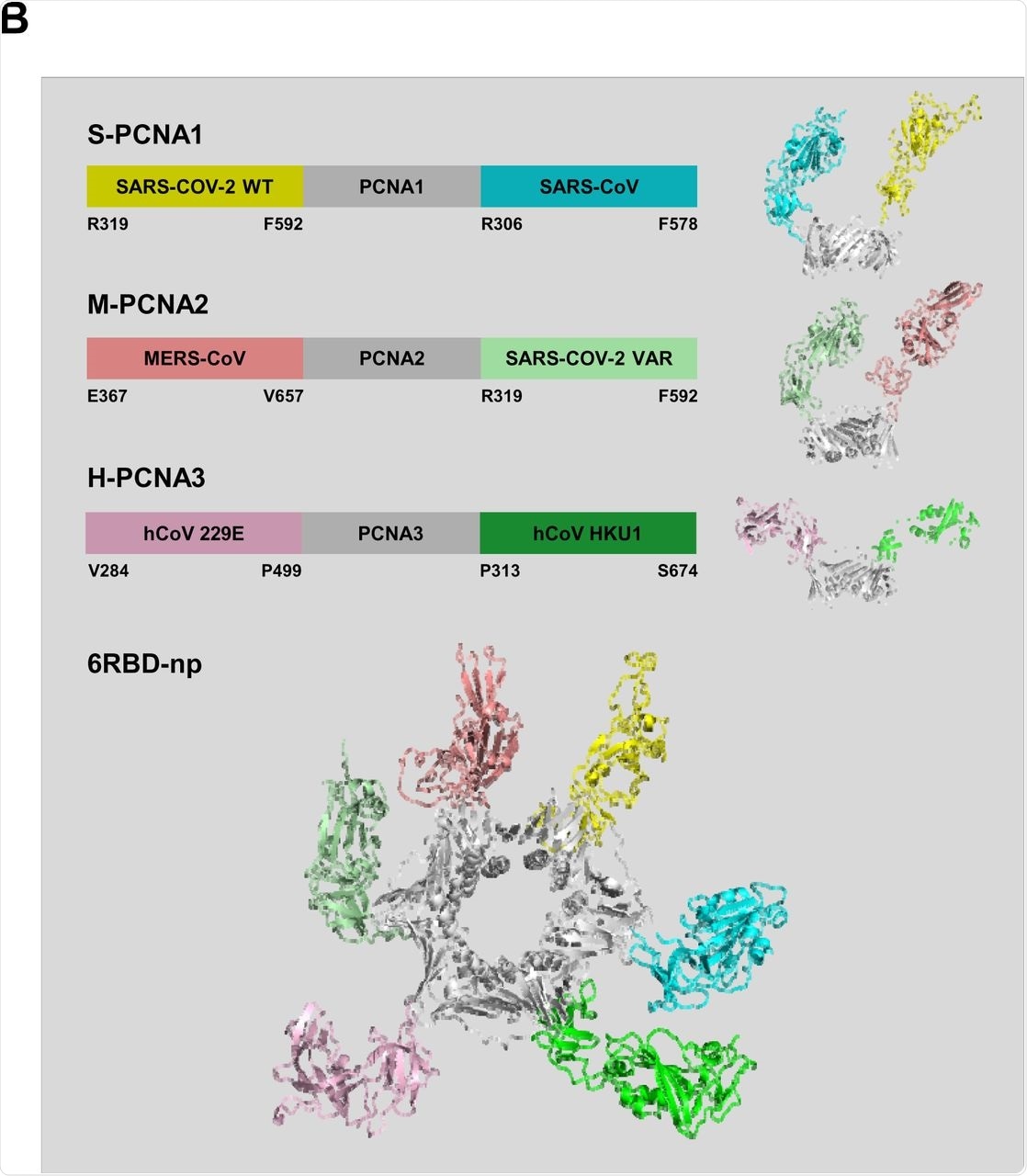
La construcción de los tres plásmidos S-PCNA1, M-PCNA2 y H-PCNA3 se basó en secuencias de proteínas de fusión obtenidas de SARS-CoV-2, MERS-CoV (MERS-CoV) y virus humano HKU1 (HKU1), respectivamente. S-PCNA1, M-PCNA2 y H-PCNA3 se aislaron mediante cromatografía de exclusión por tamaño, intercambio iónico y afinidad de etiqueta después de su expresión en células HEK 293F.
S-PCNA1, M-PCNA2 y H-PCNA3 se mezclaron secuencialmente para formar nanopartículas de mosaico multivalentes denominadas 6RBD-np. El ensamblaje, el tamaño y la morfología de 6RBD-np se caracterizaron aún más mediante el uso de microscopía de fuerza atómica (AFM) y microscopía electrónica de transmisión (TEM).
Diseño y caracterización del antígeno 6RBD-np. (a) Diagrama esquemático de la estructura central del SARS-CoV-2 teñida con esferas (panel superior). La región S1 contiene el dominio NTD y N-terminal; RBD, dominio de unión al receptor; SD1, SD2, subdominio 1 y 2, y región S2. Los sitios de mutación de las variantes del SARS-CoV-2 se indican mediante líneas verticales amarillas. Las regiones RBD y SD1 se derivan de 319 a 592 para SARS-CoV-2 WT y su variante, 306 a 578 para SARS-CoV, 367 a 657 para MERS-CoV, 313 a 674 para hCoV-HKU1 y 284 a 499 para proteínas de punta hCoV-229E. Estructura triple prefusionada de la proteína SARS-CoV-2 (panel inferior). Un objeto en bruto aparece en la representación de la barra y está coloreado como en el diagrama de estructura básica. Los dos protómeros restantes se muestran como superficies moleculares en gris. ( b ) Diseño de S-PCNA1, M-PCNA2 y H-PCNA3 que muestra esquemas de las proteínas de fusión RBD-PCNA del pico CoV (panel superior): S-PCNA1, M-PCNA2 y H-PCNA3. S-PCNA1 y SARS-CoV-2 RBD-SD1 WT-PCNA1-SARS-CoV RBD-SD1; M-PCNA2 y MERS-CoV RBD-SD1-PCNA2-SARS-CoV-2 RBD-SD1 VAR; H-PCNA3, hCoV 229E RBD-SD1-PCNA3-hCoV HKU1 RBD-SD1. Los modelos moleculares compuestos para S-PCNA1, M-PCNA2 y H-PCNA3 se muestran a la derecha. Modelo molecular de 6RBD-np que muestra el bucle PCNA (gris) y 6 proteínas RBD-SD1 coloreadas como en el diagrama esquemático (panel inferior). Los modelos se generaron a partir de las estructuras de los ID de PDB: 6VXX, 5W9P, 5X5B, 6U7H, 5I08 y 2HIK para las proteínas de punta SARS-CoV-2, MERS-CoV, SARS-CoV, hCoV 229E, hCoV HKU1 y PCNA, respectivamente. (C) El 6RBD-np purificado se marcó con SEC-MALS para mostrar su peso molecular de 355,7 kDa, lo que indica la estabilidad del 6RBD-np autoensamblado.
La eficacia de 6RBD-np en vivo
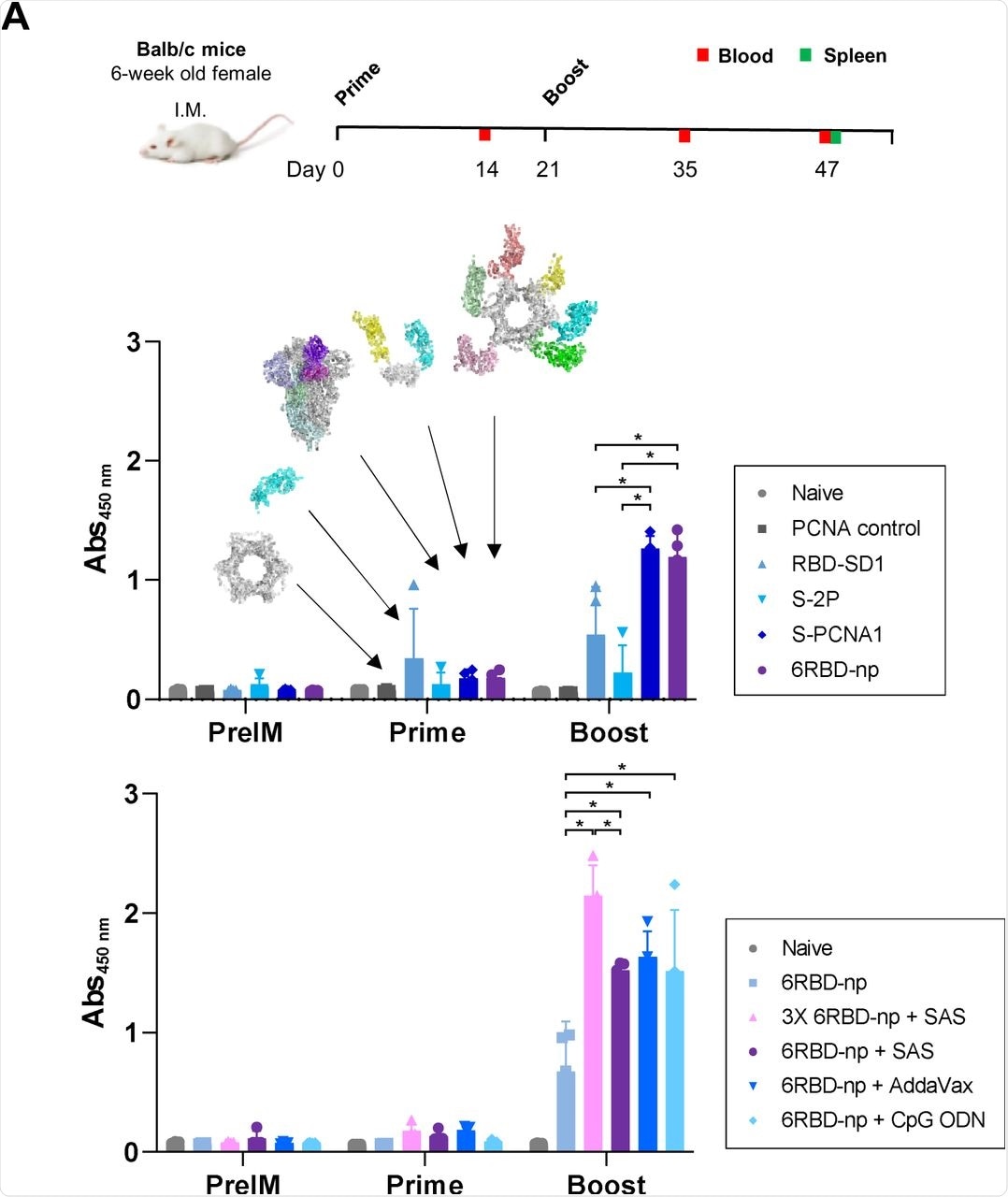
La respuesta inmunitaria inducida por 6RBDnp se evaluó en ratones BALB/c que recibieron dos inyecciones intramusculares de 6RBD-np con tres semanas de diferencia. Se recogieron muestras de sangre dos semanas después de la vacunación inicial, así como dos y cuatro semanas después de la segunda dosis de refuerzo.
Los ratones que recibieron S-PCNA1 solo, así como los que recibieron 6RBD-np, mostraron los títulos de anticuerpos más altos después de la dosis de refuerzo, lo que demuestra que estos dos tratamientos lograron una respuesta sólida de anticuerpos.
Investigaciones adicionales después del desafío con SARS-CoV-2, SARS-CoV y hCoV HKU1 mostraron que los ratones tratados con S-PCNA1 y 6RBD-np produjeron títulos altos de anticuerpos contra SARS-CoV-2 y SARS-CoV, mientras que 6RBD-np es el único tratamiento que estimuló con éxito el título de anticuerpos contra HKU1. También se descubrió que el tratamiento con 6RBD-np neutraliza la entrada de pseudovirus que expresan la proteína de punta del SARS-CoV, así como las proteínas de punta del SARS-CoV-2 que contienen mutaciones D614G, Delta o SD1.
(A) Diseño del estudio de inmunización potenciadora de Prime con ratones BALB/c (panel superior). Los ratones fueron vacunados en seis grupos. Se recogió sangre 2 semanas después de las vacunas de refuerzo y 26 días después del refuerzo. Títulos de Ab de resistencia a RBD después del cebado y después del refuerzo en ratones BALB/c, para diferentes inmunógenos de grupos de control naive y PCNA, RBD-SD1 para SARS-CoV-2, S-2P de SARS-CoV-2, S-PCNA1, y 6RBD -np, se representan como estructuras moleculares de inmunógenos relevantes con flechas (panel central). Se realizaron experimentos adicionales para diferentes dosis y adyuvantes (panel inferior), en grupos de 5 μg, 15 μg de 6RBD-np y 5 μg de 6RBD-np en presencia de SAS, AddaVax y CpG-ODN. El grupo de 15 μg de 6RBD-np muestra la mayor respuesta a Ab, en comparación con los otros grupos.
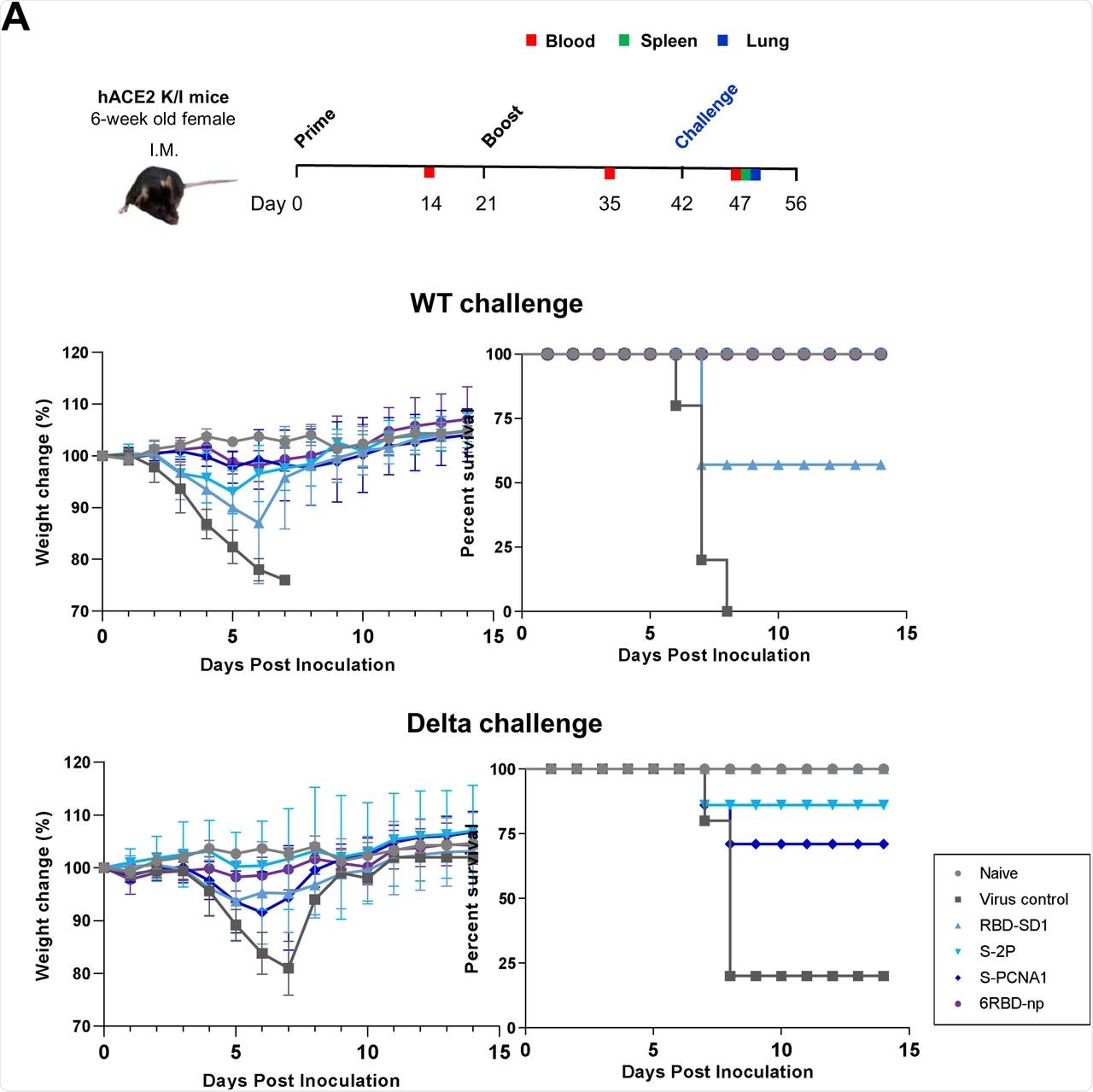
Los ratones que fueron modificados genéticamente para expresar el receptor 2 de la enzima convertidora de angiotensina humana (hACE2), que se requiere para la entrada celular del SARS-CoV-2, luego se trataron con dos vacunas con tres semanas de diferencia. Cuarenta y dos días después de la primera dosis, todos los ratones fueron desafiados con una inoculación intranasal de SARS-CoV-2 (WT) de tipo salvaje o delta.
Los ratones tratados con S-2P, S-PCNA1 y 6RBD-np y posteriormente desafiados con SARS-CoV-2 WT mostraron tasas de supervivencia del 100 %. En comparación, los ratones que recibieron tratamiento con RBD-SD1 y 6RBD-np antes de la exposición delta también mostraron una supervivencia del 100 %.
En particular, el tratamiento con 6RBD-np produjo tasas de supervivencia posteriores a la exposición del 100 % para las cepas SARS-CoV-2 WT y delta. Los pulmones y el cerebro de los ratones tratados con 6RBD-np también mostraron títulos virales más bajos a los 5 días posteriores a la infección (dpi) con los desafíos WT y Delta.
Los tratamientos con S-PCNA1 y 6RBD-np también produjeron altas respuestas de anticuerpos en el suero después de la exposición a las cepas SARS-CoV-2 WT y Delta.
Eficacia protectora e inmunogénica de antígenos contra WT SARS-CoV-2 y desafíos delta en ratones transgénicos hACE2. ( a ) Diseño de estudio de inmunización de refuerzo principal y desafío utilizando ratones transgénicos hACE2 (panel superior). Pérdida de peso y supervivencia de ratones transgénicos hACE2, después del desafío SARS-CoV-2 WT o Delta hasta 14 días después de la infección, en combinaciones de RBD-SD1 y S-2P de SARS-CoV-2, S-PCNA1 y 6RBD- np (n = 10), incluidos los grupos de control ingenuos (n = 6) y infectados por virus (n = 8). El grupo de mosaico 6RBD-np que se muestra en violeta muestra ligeros cambios en el peso corporal y la supervivencia, y es el único grupo que muestra tasas de supervivencia del 100 %, independientemente de las cepas del virus (paneles medio e inferior). Los ratones ingenuos se muestran con una línea azul.
perspectivas de futuro
En conjunto, los resultados del estudio actual muestran que el tratamiento con 6RBD-np produjo respuestas de anticuerpos significativas y dependientes de la dosis e indujo una protección completa contra los desafíos SARS-CoV-2 WT y Delta en ratones transgénicos BALB/c y hACE2. Estos resultados demuestran la utilidad potencial de estas nanopartículas de mosaico para mostrar antígenos heterogéneos que podrían usarse en futuros diseños de vacunas innovadoras.
*Nota IMPORTANTE
bioRxiv Publica informes científicos preliminares que no han sido revisados por pares y, por lo tanto, no deben considerarse concluyentes, orientar la práctica clínica o el comportamiento relacionado con la salud ni tratarse como información establecida.

«Gurú del alcohol. Analista. Defensor de la comida. Aficionado extremo al tocino. Experto total en Internet. Adicto a la cultura pop. Pionero de viajes sutilmente encantador».